
“ 理解納米材料與生物系統(tǒng)之間的相互作用對(duì)于提高納米藥物的有效性和加深對(duì)生物領(lǐng)域的理解起著至關(guān)重要的作用。熒光顯微鏡是一種強(qiáng)大的光學(xué)成像技術(shù),可以直接觀察細(xì)胞內(nèi)微環(huán)境中熒光標(biāo)記納米材料的行為蜈缤。然而吁断,傳統(tǒng)的熒光顯微鏡,如共聚焦顯微鏡呕臂,由于光的衍射而具有有限的光學(xué)分辨率,因此無(wú)法提供直徑小于 250 nm 的納米材料的精確細(xì)節(jié)。幸運(yùn)的是沼津,超分辨率熒光顯微鏡的發(fā)展克服了分辨率的限制,能夠?qū){米細(xì)胞相互作用進(jìn)行更全面的研究泽衬。在此科绣,我們總結(jié)了通過(guò)各種超分辨率顯微技術(shù)研究的納米細(xì)胞相互作用的最新進(jìn)展。”
為了充分了解納米材料與細(xì)胞內(nèi)結(jié)構(gòu)域的相互作用树碱,必須更詳細(xì)地了解物理化學(xué)特性在決定納米材料的細(xì)胞結(jié)合肯适、內(nèi)化、加工和細(xì)胞內(nèi)命運(yùn)中的作用成榜,這需要具有更高質(zhì)量的多色成像技術(shù)框舔。因此,需要能夠克服熒光顯微鏡光學(xué)分辨率限制的新方法赎婚。在過(guò)去的幾十年里刘绣,超分辨率熒光顯微鏡或突破衍射極限的熒光顯微鏡已經(jīng)被開(kāi)發(fā)出來(lái),允許以超出衍射極限的更高分辨率捕獲圖像挣输,分辨率能達(dá)到5 nm左右纬凤。特別是福贞,在2014 年 10 月 8 日,諾貝爾化學(xué)獎(jiǎng)授予Eric Betzig停士,William. E. Moerner和Stefan W. Hell的“超分辨熒光顯微鏡的發(fā)展”挖帘,將“光學(xué)顯微鏡帶入納米維度”,填補(bǔ)了電子顯微鏡和熒光顯微鏡的空白恋技。

《Advances in super-resolution fluorescence microscopy for the study of nano–cell interactions》
01研究結(jié)果
1拇舀、超分辨率顯微鏡分類
超分辨率顯微鏡可大致分為兩大類:“真正的”超分辨率技術(shù)捕捉倏逝波中包含的信息并直接給出超分辨率圖像;和“功能性”超分辨率技術(shù)夜川,使用智能實(shí)驗(yàn)技術(shù)和對(duì)被成像樣本的已知限制來(lái)重建和產(chǎn)生確定性(利用非線性熒光團(tuán)的響應(yīng))或隨機(jī)(利用熒光團(tuán)的復(fù)雜時(shí)間行為)超分辨率圖像日俱。超分辨率方法也可以通過(guò)三個(gè)著名的家族來(lái)識(shí)別,如圖 1 所示麻百,包括(i)“結(jié)構(gòu)化照明”SIM (ii) “受激發(fā)射損耗”方法STED款拣;和(iii) “單分子定位”方法,其中單個(gè)熒光分子按順序定位拴猖,并以采集亮點(diǎn)方式重建圖像朋傲。其中SIM、STED伐蔚、STORM昨跺、PALM、PAINT等多種超分辨率技術(shù)已成功應(yīng)用于生物領(lǐng)域谁意。
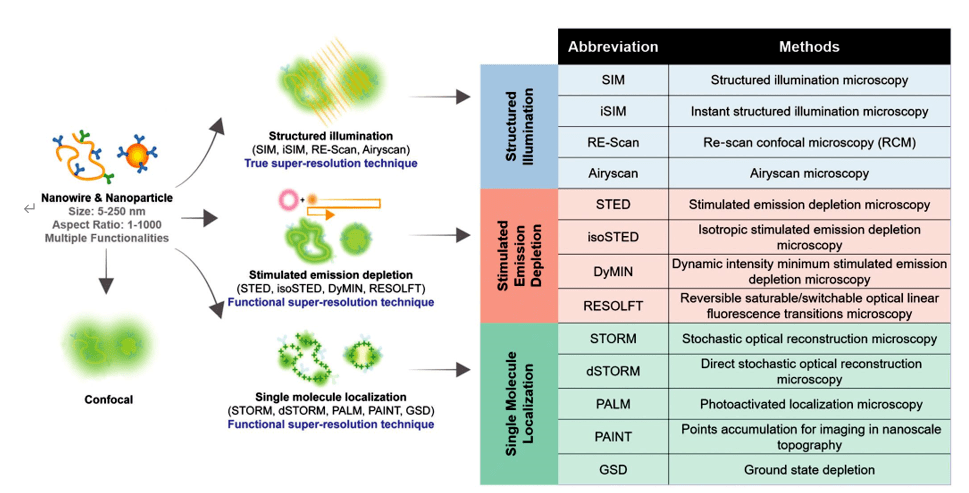
圖1. 超分辨率方法目錄及其用于觀察納米材料的代表性機(jī)制的說(shuō)明发娶,包括結(jié)構(gòu)化照明、受激發(fā)射損耗和單分子定位
2料潘、使用超分辨率熒光顯微鏡研究納米生物相互作用
2.1 結(jié)構(gòu)照明顯微鏡(SIM)
SIM 是一種超分辨率熒光顯微鏡方法抽碌,它通過(guò)利用莫爾條紋來(lái)提高空間分辨率,該莫爾條紋包含在觀察區(qū)域中編碼的其他無(wú)法觀察的結(jié)構(gòu)信息决瞳。使用特定的光柵在不同角度形成衍射圖案货徙,從而產(chǎn)生包含附加信息的莫爾圖案(圖 1)。因此皮胡,當(dāng)使用這些多個(gè)光柵角度(三個(gè)以上不同的角度)時(shí)痴颊,可以從樣本中提取大約兩倍的信息量。該信息可用于以數(shù)學(xué)方式重建超分辨率圖像屡贺,其橫向分辨率為 110 nm蠢棱,軸向分辨率為 250 nm。即時(shí) SIM 和非線性 SIM 等方法已經(jīng)能夠?qū)崿F(xiàn) 50 nm 的空間分辨率甩栈。SIM廣泛用于納米生物相互作用研究裳扯,由于其以每個(gè)顏色通道超過(guò) 10 Hz 的幀速率進(jìn)行快速成像采集。SIM 增強(qiáng)的分辨率增加了納米材料與圖像中觀察到的細(xì)胞內(nèi)細(xì)胞器的共定位信號(hào)。
使用共聚焦顯微鏡和 SIM 檢測(cè) HeLa 細(xì)胞中的金屬氧化物納米粒子饰豺。他們表明亿鲜,當(dāng)使用 SIM 成像時(shí),通過(guò)共聚焦顯微鏡獲得的圖像中似乎是納米顆粒和溶酶體共定位的一些區(qū)域被證明不是真正的共定位冤吨。納米顆林穸牵可能包含在其他膜結(jié)合結(jié)構(gòu)(例如,內(nèi)體)中(圖 2i)训寝。在這種情況下勾勃,SIM 能夠更準(zhǔn)確地識(shí)別與溶酶體共定位的納米顆粒,這有助于納米藥物載體設(shè)計(jì)恨蒙,該載體設(shè)計(jì)結(jié)合了 pH 觸發(fā)的藥物釋放区糟,以實(shí)現(xiàn)精確的治療有效載荷遞送。
圖2. SIM 研究的納米細(xì)胞相互作用教够,包括納米顆粒的共定位潮兼、納米膠囊的細(xì)胞內(nèi)變形和內(nèi)化納米膠囊的量化
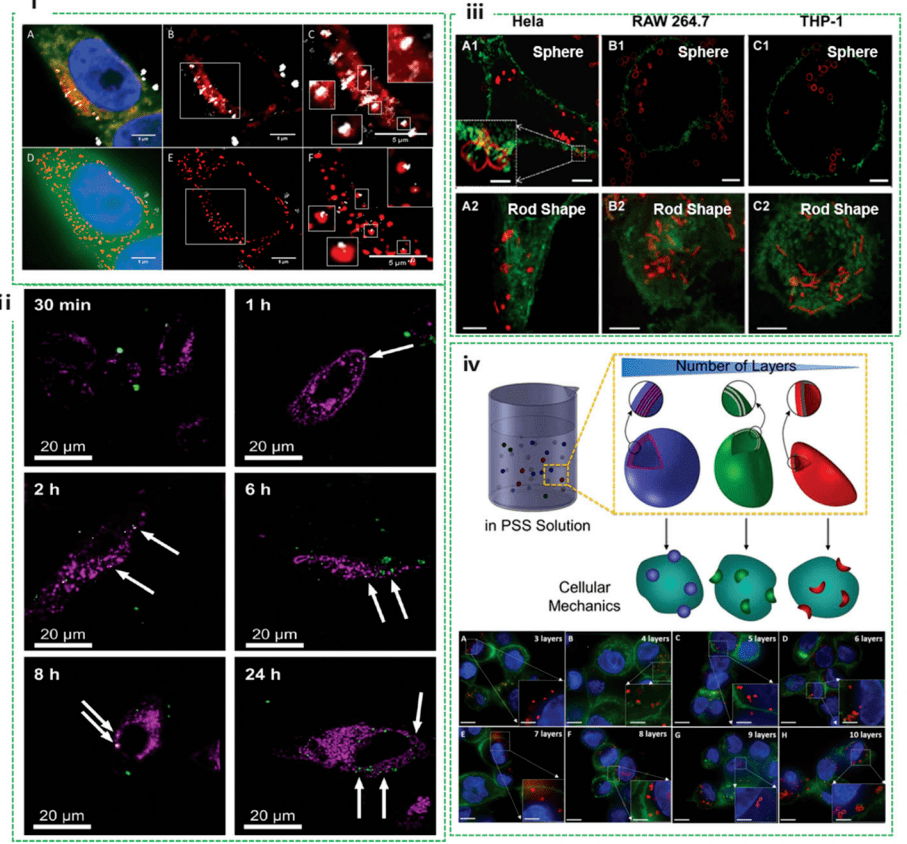
研究人員 通過(guò)使用 SIM,在 24 小時(shí)內(nèi)捕獲金屬有機(jī)框架 (MOF) 進(jìn)入 HeLa 細(xì)胞的過(guò)程杠捂。結(jié)果表明始树,由于細(xì)胞內(nèi)和細(xì)胞外空間之間的介質(zhì)差異,細(xì)胞外空間中的 MOF 比位于細(xì)胞內(nèi)的 MOF 移動(dòng)得更快(圖 2ii)赋芥。進(jìn)一步研究發(fā)現(xiàn)绳宰,MOFs 吸收到 HeLa 細(xì)胞中既不受藥物模型(鈣黃綠素)加載的影響,也不受溫度處理過(guò)程的影響一膨。納米粒子在內(nèi)化過(guò)程中的變形特性提供了對(duì)其穩(wěn)定性和細(xì)胞內(nèi)潛在作用機(jī)制的深入了解呀邢。然而,使用傳統(tǒng)的共聚焦顯微鏡豹绪,在與生物系統(tǒng)相互作用時(shí)確定納米結(jié)構(gòu)形態(tài)的細(xì)微變化通常具有挑戰(zhàn)性驼鹅。 學(xué)者們探索了 SIM 以研究各種細(xì)胞系中聚合物膠囊的細(xì)胞內(nèi)變形。據(jù)觀察森篷,膠囊的變形取決于細(xì)胞系(圖 2iii),包括 HeLa豺型、Raw264.7 和不同的 THP-1仲智,但與膠囊的形狀(球體和棒狀)無(wú)關(guān)。這表明機(jī)械力因細(xì)胞系而異姻氨,因?yàn)?HeLa 中發(fā)生的變形百分比最高钓辆,其次是 RAW264.7 和分化的 THP-1 細(xì)胞。此外肴焊,他們精確量化了用聚合物納米膠囊區(qū)分 THP-1 細(xì)胞的細(xì)胞內(nèi)化機(jī)制前联。 在細(xì)胞內(nèi)化過(guò)程中施加在膠囊上的壓力通過(guò)評(píng)估 SIM 可視化的膠囊變形程度來(lái)量化(圖 2iv)。這項(xiàng)開(kāi)創(chuàng)性工作為檢測(cè)細(xì)胞力學(xué)提供了一種實(shí)用的方法,這對(duì)于揭示細(xì)胞力學(xué)生物學(xué)和設(shè)計(jì)對(duì)細(xì)胞機(jī)械力敏感的先進(jìn)材料具有重要意義橱孽。
2.2 受激發(fā)射損耗顯微鏡(STED)
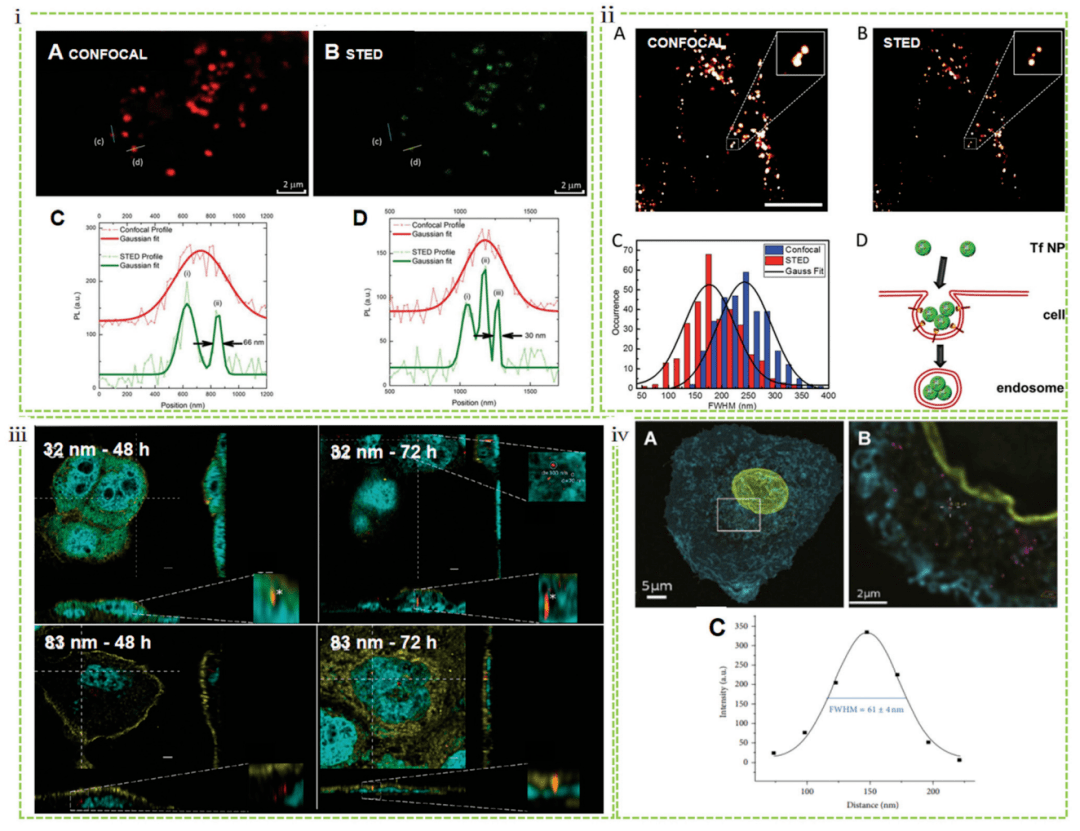
STED 耗盡點(diǎn)擴(kuò)散函數(shù)外部區(qū)域的熒光團(tuán)以銳化焦點(diǎn)拥臼,因此將橫向和軸向的分辨率提高到 25-80 nm(圖 1)。與SIM愁豆、STED 允許更高的分辨率搭奄,不需要后數(shù)學(xué)處理,具有實(shí)時(shí)成像和快速采集的能力招狈。例如艇氯,STED 顯微鏡成功地用于對(duì)固定和活的 MCF7 細(xì)胞中碳點(diǎn)的定位進(jìn)行成像,與傳統(tǒng)的共聚焦顯微鏡相比类棍,空間分辨率提高了 6 倍以上药炊,低至 30 nm(圖 3i)。同樣堡迷,STED 也被應(yīng)用于成像活細(xì)胞與轉(zhuǎn)鐵蛋白的相互作 用变跃。與共焦圖像相比,納米粒子具有大約 4 倍的分辨率增強(qiáng)讥高。這種 STED 不僅能夠?qū)罴?xì)胞中這些基于蛋白質(zhì)的結(jié)構(gòu)進(jìn)行精確成像揣誓,而且還揭示了早期內(nèi)體結(jié)構(gòu)內(nèi)化后顆粒的富集(圖 3ii)。Kraegeloh 的小組首先應(yīng)用 STED 來(lái)研究納米粒子與細(xì)胞的相互作用巾陕。他們使用 STED 確定了人結(jié)腸癌細(xì)胞 (Caco-2) 內(nèi)熒光二氧化硅顆粒(直徑為 32 和 83 nm)的團(tuán)聚體尺寸讨跟。與 83 nm 粒子相比,32 nm 粒子遷移的定量評(píng)估表明鄙煤,更多的 32 nm 粒子被內(nèi)化晾匠,并且它們遷移到細(xì)胞中的速度更快。只有 32 nm 的顆粒穿透細(xì)胞核并在 48 小時(shí)后形成 200 nm 的附聚物梯刚,72 小時(shí)后在核中形成 300 nm 的附聚物(圖 3iii)凉馆。這項(xiàng)工作為研究納米材料的多向性相互作用開(kāi)辟了一條途徑。Kraegeloh 的小組首次進(jìn)一步證明亡资,可以通過(guò)圖像處理從整個(gè)細(xì)胞的 3D STED 圖像堆棧中提取肺上皮細(xì)胞 (A549) 內(nèi)化的二氧化硅納米粒子數(shù)量的定量估計(jì)澜共。STED 圖像在 A549 細(xì)胞攝入于直徑為 25 nm 的納米粒子5 小時(shí)后進(jìn)行拍攝(圖 3iv)。
圖 3 STED 研究的納米細(xì)胞相互作用锥腻,包括納米顆粒的內(nèi)吞作用機(jī)制和內(nèi)化量化
2.3 隨機(jī)光學(xué)重建顯微鏡(STORM)
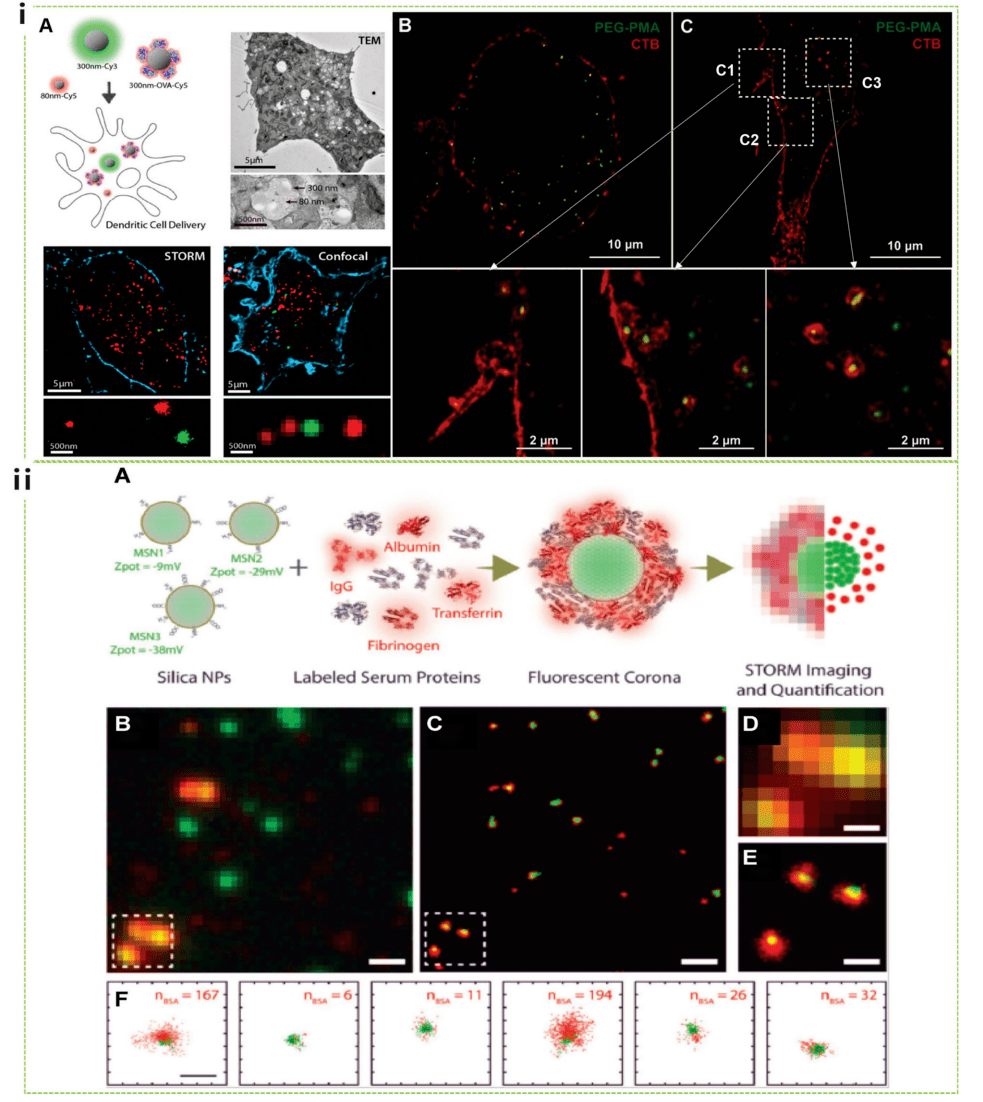
STORM 基于對(duì)單個(gè)隨機(jī)閃爍熒光團(tuán)的準(zhǔn)確定位嗦董,可以提供高分辨率圖像,分辨率比標(biāo)準(zhǔn)熒光顯微鏡高 數(shù)十倍瘦黑。STORM 已經(jīng)成功在生物學(xué)研究中完全用于發(fā)現(xiàn)未揭示的細(xì)胞結(jié)構(gòu)京革。De Geest 和 Albertazzi 將 STORM 與單分子數(shù)據(jù)分析相結(jié)合,探索納米粒子進(jìn)入細(xì)胞過(guò)程中的行為趾倾,提供對(duì)納米粒子相互作用的定量研究與細(xì)胞膜和隨后的吸收機(jī)制有關(guān)贪挽。值得注意的是场陪,他們直接比較了使用 TEM、STORM 和共聚焦顯微鏡獲得的細(xì)胞內(nèi)納米粒子的圖像(圖 4i)泵易。STORM 最近還被用于納米生物相互作用的定量體外研究干蒸,其中研究人員研究了圍繞納米顆粒的蛋白冠的形成如何影響注射納米顆粒的穩(wěn)定性、靶向能力和免疫原性洁揽,以發(fā)揮其治療潛力叙杨。Albertazzi 的小組證明,MSN 之間表面化學(xué)的細(xì)微初始差異可以導(dǎo)致異質(zhì)蛋白質(zhì)擴(kuò)增粒子的多樣性杉轿,導(dǎo)致具有不同蛋白質(zhì)層和不同理化性質(zhì)的粒子共存(圖 4ii)疙鸟。
圖4 STORM 研究的納米細(xì)胞相互作用,包括攝取機(jī)制和蛋白冠的形成
2.4 光活化定位顯微鏡(PALM)
PALM 利用光開(kāi)關(guān)熒光蛋白來(lái)激活分子亞群以進(jìn)行隨機(jī)順序單分子識(shí)別昏络∈鞔鳎活細(xì)胞 PALM 的一個(gè)有前途的應(yīng)用是使用光活化來(lái)執(zhí)行高密度單粒子跟蹤,克服了單粒子跟蹤的傳統(tǒng)限制慕然,以與顯示非常低濃度熒光團(tuán)的系統(tǒng)一起工作万栅。通過(guò)使用 PALM 結(jié)合單粒子追蹤,研究了聚苯乙烯基納米粒子內(nèi)吞的動(dòng)態(tài)內(nèi)吞過(guò)程西疤,這允許在活細(xì)胞環(huán)境中可視化網(wǎng)格蛋白介導(dǎo)的納米粒子內(nèi)吞作用烦粒。結(jié)果表明,在大多數(shù)事件中代赁,>90% 的納米顆粒首先與細(xì)胞膜結(jié)合扰她,隨后形成了氯氰菊酯涂層的小坑 (CCP),而其余的納米顆粒則在細(xì)胞膜內(nèi)擴(kuò)散以供利用由預(yù)制的 CCP芭碍。
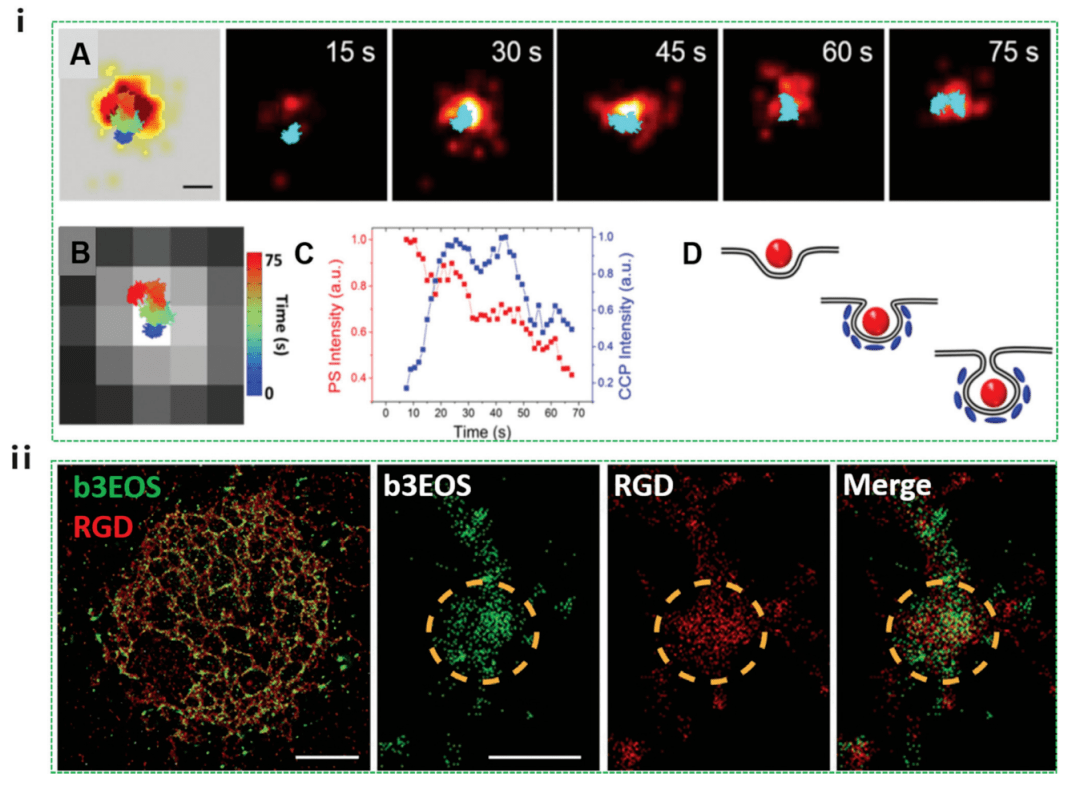
圖 5 PALM 研究的納米細(xì)胞相互作用徒役,包括細(xì)胞攝取過(guò)程和細(xì)胞內(nèi)定位
如圖 5i 所示,納米顆粒(紅色)首先粘附在質(zhì)膜上窖壕,而網(wǎng)格蛋白(藍(lán)色)不可見(jiàn)忧勿。 然后,CCP 信號(hào)逐漸增強(qiáng)瞻讽,表明 cla-thrin 向該站點(diǎn)募集鸳吸。 在這 55 ± 23 秒的持續(xù)時(shí)間內(nèi),納米粒子的發(fā)射強(qiáng)度基本保持不變速勇。 CCP 信號(hào)達(dá)到峰值后晌砾,納米顆粒強(qiáng)度開(kāi)始降低。 在后期(45-75 秒)讨拷,在 CCP 的 PALM 圖像和納米粒子軌跡中都觀察到了 100 nm 的橫向運(yùn)動(dòng),這可能是由于納米粒子在胞內(nèi)區(qū)处鲜。 雖然這項(xiàng)工作只關(guān)注網(wǎng)格蛋白介導(dǎo)的內(nèi)吞作用依粮,但它為研究 PALM 納米顆粒的其他內(nèi)吞作用機(jī)制開(kāi)辟了一條途徑。 PALM 還被用來(lái)表征和量化 10 nm 分辨率下不同剛度的 RGD 矩陣上的早期整合素簇(圖 5ii)。 結(jié)果表明党令,非常早期的粘連由 50 個(gè) β3 激活的整聯(lián)蛋白的 100 nm 簇組成锚渺。 這些早期的粘連形成類似地在柔性和剛性基材上,但是大多數(shù)粘附在剛性基材上是暫時(shí)的猖等。
02研究總結(jié)
過(guò)去的十年中歪缅,隨著超分辨率技術(shù)的整合,納米細(xì)胞相互作用中的光學(xué)顯微鏡領(lǐng)域經(jīng)歷了復(fù)興谎秃。盡管仍然存在一些擔(dān)憂鼓募,超分辨率顯微鏡與其他熒光顯微鏡技術(shù)一樣,依賴于細(xì)胞內(nèi)熒光分子的表達(dá)弱瞄,通常是通過(guò)引入可直接影響細(xì)胞生理的外部基因买雾,因此可能無(wú)法反映“真實(shí)”的納米細(xì)胞相互作用,毫無(wú)疑問(wèn)杨帽,超分辨率技術(shù)的發(fā)展代表了一項(xiàng)重大進(jìn)步漓穿,也是了解納米材料在生物領(lǐng)域之旅中的行為的有力工具。
以納米分辨率直接可視化納米材料的能力產(chǎn)生了關(guān)鍵信息注盈,例如單個(gè)內(nèi)吞事件的機(jī)制晃危、細(xì)胞內(nèi)納米粒子的追蹤以及治療有效載荷的細(xì)胞內(nèi)位置。必須了解這些作用機(jī)制老客,才能設(shè)計(jì)出具有增強(qiáng)內(nèi)化效率和跟蹤動(dòng)力學(xué)的安全納米粒子僚饭。反過(guò)來(lái),此類信息可用于加深對(duì)生物環(huán)境的基本了解沿量。隨著超分辨率顯微鏡技術(shù)(例如更好的探測(cè)器和熒光探針)的不斷發(fā)展浪慌,我們已經(jīng)看到該方法在空間和時(shí)間分辨率、復(fù)雜標(biāo)本的可訪問(wèn)性和生命系統(tǒng)的微創(chuàng)性方面的性能顯著提高朴则。這將為研究納米細(xì)胞相互作用提供更多機(jī)會(huì)权纤。
在本研究中, 這項(xiàng)2014年諾貝爾化學(xué)獎(jiǎng)的發(fā)現(xiàn)已在國(guó)內(nèi)實(shí)現(xiàn)產(chǎn)業(yè)化乌妒。 寧波 力顯智能科技 有限公司 (INVIEW) 現(xiàn)已發(fā)布超高分辨率顯微系統(tǒng) iSTORM 眉挥,采用3D隨機(jī)光學(xué)重構(gòu)技術(shù)、高精度細(xì)胞實(shí)時(shí)鎖定技術(shù)日频、多通道同時(shí)成像技術(shù)等深七,以 納米級(jí)觀測(cè)精度 、 高穩(wěn)定性 浮块、 廣泛環(huán)境適用 粉霹、 快速成像 、 簡(jiǎn)易操作 等優(yōu)異特性勉瘩,獲得了超過(guò)50家科研小組和100多位科研人員的高度認(rèn)可喉侨。
參考文獻(xiàn):
1. Advances in super-resolution fluorescence microscopy for the study of nano–cell interactions
關(guān)于我們:
寧波力顯智能科技有限公司(INVIEW)是專業(yè)從事超高分辨率顯微技術(shù)和產(chǎn)品研發(fā)的科技企業(yè)品隅,依托復(fù)旦大學(xué)的自動(dòng)控制、新一代信息技術(shù)及香港科技大學(xué)的生物青礁、光學(xué)燃徊、圖像處理等的技術(shù),擁有光學(xué)谋监、生物厚累、自控、機(jī)械本鸣、信息技術(shù)等多領(lǐng)域交叉學(xué)科技術(shù)團(tuán)隊(duì)疫衩,將2014年諾貝爾化學(xué)獎(jiǎng)技術(shù)產(chǎn)業(yè)化,推出了超高分辨率顯微產(chǎn)品永高,幫助人們以前所未有的視角觀察微觀世界隧土,突破極限,見(jiàn)所未見(jiàn)命爬。



